El término "coloide,” de las palabras griegas kolla, que significa "pegamento" y eidos, que significa "como" fue usado por primera vez en 1861 por Thomas Graham para clasificar mezclas como el almidón en el agua y la gelatina.
Muchas partículas coloidales son agregados de cientos o miles de moléculas, pero otras (como las proteínas y las moléculas de polímero) consisten en una sola molécula extremadamente grande.
Las proteínas y las moléculas de polímero sintético que forman coloides pueden tener masas moleculares que varían de unos pocos miles a muchos millones de unidades de masa atómica.
ACCIÓN
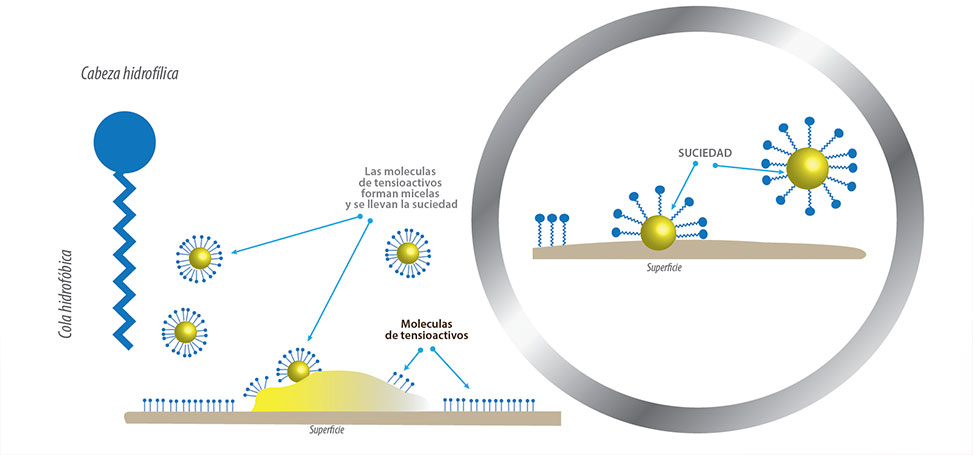
La acción de limpieza de los jabones y los detergentes se puede explicar en términos de las estructuras de las moléculas involucradas.
El extremo de hidrocarburo (no polar) de una molécula de jabón o detergente se disuelve o es atraído por sustancias no polares como el aceite, la grasa o las partículas de suciedad.
El extremo iónico es atraído por el agua (polar). Como resultado, las moléculas de jabón o detergente se orientan en la interfaz entre las partículas de suciedad y el agua, por lo que actúan como una especie de puente entre dos diferentes tipos de materia, no polar y polar.
Moléculas como esta se llaman anfifílicas ya que tienen una parte hidrofóbica y una parte hidrofílica.
Como consecuencia, las partículas de suciedad se suspenden como partículas coloidales y se eliminan fácilmente.